Clostridium perfringens typu A: skutečný enteropatogen pro selata? Články – z farmy na trh
Věřím, že některé kmeny této bakterie jsou pro selata patogenní a mohou způsobovat průjem a nízké tempo růstu; zatím je však nevíme identifikovat!

Clostridium perfringens Typ A je přirozenou součástí mikrobioty dolní části tenkého střeva a tlustého střeva u prasat a mnoha dalších druhů zvířat. Diagnóza Clostridium perfringens Bakterie typu A v posledním desetiletí zvýšila výskyt novorozeneckého průjmu u selat. Přesná role této bakterie jako primárního původce průjmu u sajících selat však není zcela známa. Hlavním problémem správné interpretace role bakterií Clostridium perfringens Typ A v případech průjmu u novorozených selat měl složitost genomu pro stanovení definitivní diagnózy. Tento aspekt bude předmětem této diskuse.
Případy klinických projevů byly popsány ve vědecké literatuře Clostridium perfringens typ A, kdy se u selat objeví průjem s krémovou nebo pastovitou konzistencí dva dny po narození, který může trvat až pět dní. Stolice může někdy zkalit. Úmrtnost se obvykle nepozoruje, ale postižená zvířata bývají ve srovnání s neinfikovanými vrstevníky opožděná ve vývoji, a proto jsou vystavena riziku dosažení požadované hmotnosti při odstavu. Neexistuje žádný jasný rozlišovací znak pro přítomnost Clostridium perfringens typ A při pitvě k odlišení od jiných možných enteropatogenů nalezených u zvířat tohoto věku. Histologicky může být přítomna povrchová nekróza špiček klků spojená s akumulací fibrinu. Léze spojená s intenzivní kolonizací tyčinkovitých bakterií v úzkém spojení s traumatizovanými enterocyty by diagnózu podpořila. Clostridium perfringens typ A (obr. 1). Takové výsledky se však vyskytují jen zřídka. Nejčastěji nejsou pozorovány žádné mikroskopické léze, což vedlo k domněnce, že tato bakteriální infekce může způsobovat sekreční průjem. Tato možnost nebyla nikdy potvrzena.

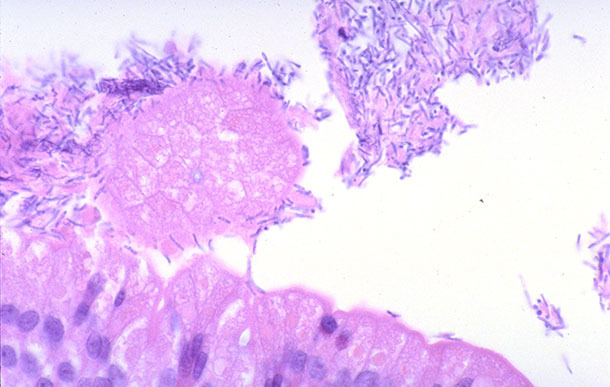
Obrázek 1. Tenké střevo selete s průjmem spojeným s infekcí Clostridium perfringens typ A. Velké množství tyčinkovitých bakterií v těsném kontaktu s enterocyty (100x). Zdroj: Profesor James Collins, Minnesotská univerzita, USA
Gramovo barvení vypadá stejně pro všechny typyLostridium perfringens ze strany bakteriálních kolonií a beta-hemolýzy v krevním agaru. Jediný způsob, jak rozlišit těchto pět typů Clostridium perfringens A až E je založeno na produkci čtyř hlavních toxinů: alfa, beta, epsilon a iota. Existují také dva další důležité toxiny, enterotoxin a beta-2, které je třeba zmínit. Všechny typy Clostridium perfringens lze nalézt v gastrointestinálním traktu selat, ale pouze typy A a C jsou považovány za patogenní pro tento věk selat. Existuje velmi vysoká korelace mezi detekcí kódujících genů pro tyto toxiny CPA, CPB, ETX, IA, CPE a CPB2 (Tabulka 1) a jejich projevy, což znamená, že detekce těchto genů pomocí PCR bude stejná jako detekce toxinu ve stolici. Všechny typy Clostridium perfringens mají gen cpa. Detekce genů cpa i cpb by mohla identifikovat bakterie typu C, zatímco detekce samotného genu cpa by mohla identifikovat bakterie typu A.
Tabulka 1. Definice typů Clostridium perfringens, založené na produkci toxinů
Typ Clostridium perfringens

Toxin A negativní, toxin B pozitivní Clostridium difficile Clostridium difficile je běžný nozokomiální patogen a hlavní příčina infekčního průjmu u hospitalizovaných pacientů. Kolonizace C. difficile je spojena s širokou škálou klinických projevů, od asymptomatického nosičství až po fulminantní pseudomembranózní kolitidu. V posledních letech se výskyt C. difficile a počet případů spojených s vážnými následky celosvětově vzrostl. To může být způsobeno několika faktory, včetně měnících se demografických údajů pacientů přijatých do nemocnice, změn v politikách kontroly infekcí nebo vzniku virulentnějších kmenů C. tvrdý. Dva strukturně podobné toxiny, označené TcdA (308 kDa) a TcdB (270 kDa), jsou hlavními determinanty virulence spojené s onemocněním spojeným s Clostridium difficile (CDAD) a většinou patogenních kmenů C. difficile produkuje oba toxiny (A+B+). Oba tyto hlavní toxiny jsou glukosyltransferázy, které katalyzují monoglukosylaci threoninu 35/37 malých GTP-vázajících proteinů Rho, Rac a Cdc42 v cílových buňkách, a tím modulují několik fyziologických buněčných dějů vedoucích k buněčné smrti. Strukturálně mají tyto toxiny tři domény: enzymatická aktivita je lokalizována na N-konci proteinu, střední doména je předpokládanou translokační oblastí a C-konec se podílí na vazbě na receptor. N-konce TcdA a TcdB vykazují 74% homologii, což vysvětluje jejich podobnou substrátovou specificitu. Karboxy-terminální doména obou toxinů nese řadu krátkých homologních oblastí nazývaných kombinované repetitivní oligopeptidy (CROP). Role těchto toxinů v patogenezi CDAD je dobře popsána. Toxiny A i B mají v lidském tlustém střevě prozánětlivé, cytotoxické a enterotoxické účinky. Tyto toxiny jsou kódovány dvěma geny, tcdA a tcdB, které se mapují na 19,6 kb dlouhý lokus patogenity (PaLoc) obsahující další regulační geny. Byly zkoumány izoláty C. difficile s různými genetickými modifikacemi v PaLoc a bylo popsáno 28 různých toxinotypů. Patří mezi ně i možnost C. difficile, které mají delece, inzerce nebo polymorfní restrikční místa v jednom nebo více genech PaLoc, ale které stále mohou produkovat funkční toxinové proteiny TcdA a TcdB, a také kmeny s toxinovými variantami (A−B+), které neprodukují detekovatelný toxin A. Kmeny s toxinovými variantami, které produkují buď toxin A, nebo toxin B, jsou nejčastěji izolovanou variantou C. obtížné s úpravami v jejich PaLoc. Až donedávna se předpokládalo, že všechny toxigenní kmeny spojené s tímto onemocněním produkují jak TcdA, tak TcdB. První studie na zvířecích modelech ukázaly, že TcdA a TcdB působí synergicky, ale TcdA je nezbytný pro počáteční poškození v tlustém střevě. V důsledku toho se velká část výzkumu patogeneze CDAD zaměřila na zánět modulovaný toxinem A. Mnoho nedávných zpráv však ukazuje klinický význam izolátů A-negativního toxinu a B-pozitivních (A−B+) izolátů. Výskyt průjmu C. difficile, sporadické případy infekce a případy pseudomembranózní kolitidy (PMC) způsobené A−B+C. difficile, byly dříve zdokumentovány. A−B+ Clostridium difficile Doposud byly popsány a charakterizovány čtyři různé kmeny Clostridium difficile A−B+ pomocí Rupnikova toxinotypizačního schématu (PCR-RFLP). Na začátku 1990. let byly identifikovány dva typy kmenů A-B+, které produkovaly TcdB, ale nedetekovatelný TcdA. Kmen 8864, první charakterizovaný kmen toxinové varianty, způsoboval krvácení, hromadění tekutin a poškození tkáně v podvázaných smyčkách králičího ilea. Molekulární analýza odhalila rozsáhlou deleci o délce 5,9 kb v mapování PaLoc na 3′ konci tcdA a tcdC, která zabránila produkci TcdA na transkripční úrovni. Kromě toho existuje 1,1 kb inzerce mezi tcdA a tcdE. Toxinotypizace označuje tento typ kmene jako toxinotyp X. První studie ukázaly, že tento typ kmene produkuje modifikovanou formu TcdB, a následné analýzy zjistily, že TcdB-8864 indukuje odlišný cytopatický účinek (CPE) ve srovnání s TcdB-10463 (TcdB-8864 glukosyluje Rho proteiny Rac1, Rap 1/2 a Ral). Pouze jeden organismus kmene 8864 byl kdy izolován (z asymptomatického dospělého) a ačkoli je klinický význam tohoto kmene u lidí sporný, jeho virulence na zvířecích modelech podporuje jeho patogenní potenciál. Druhá kategorie identifikovaných typů kmenů A-B+ zahrnovala kmeny séroskupiny F (kmen typu 1470), které byly považovány za nepatogenní kvůli jejich časté izolaci od asymptomatických kojenců a absenci patogenity u zvířecích modelů. Stejně jako kmen 8864 jsou také zkráceny v 3′ oblasti repetitivní domény tcdA. Obsahují deleci 1,8 kb v genu tcdA spolu s mutací, která zavádí stop kodon odpovídající pozici aminokyseliny 47, což vede ke zkrácení genu TcdA-1470. Toxinotypizace klasifikovala tyto organismy jako typ VIII. Analýza TcdB-1470 ukázala, že tento toxin má také polymorfismy ve svém genu tcdB, což vede ke změněné glukosylaci a diferenciálním cytopatickým účinkům. Sekvenční analýza TcdB z kmenů 8864 a 1470 odhalila vysoký stupeň konzervace sekvence v enzymatické doméně se substitucemi pouze na 8 z 560 aminokyselinových pozicích. Tyto nové cytotoxiny jsou hybridem mezi TcdB z referenčního kmene VPI 10463 a letálním toxinem Clostridium sordellii (TclS). Zatímco vazebná doména receptoru sdílí 100% homologii s TcdB-10463, enzymatická doména je homologní pouze ze 79 %. Tyto hybridní toxiny naznačují, že mezi velkými kmeny klostridií produkujícími klostridiové toxiny (LCT) mohlo dojít ke genetické výměně a rekombinaci. V poslední době byly popsány dva další kmeny A-B+, toxinotypy XVI a XVII. Je zajímavé, že tyto nové toxinotypy obsahují geny kódující binární toxin Clostridium difficile. Molekulární mechanismus zodpovědný za nedostatečnou produkci toxinu A u těchto nových toxinotypů dosud nebyl popsán, ačkoli tyto kmeny mají také delece v oblasti CROP genu tcdA. Ačkoli byly popsány čtyři typy kmenů A-B+, toxinotyp VIII se jeví jako klinicky nejvýznamnější variantní typ kmene s toxinem. Byly izolovány ze čtyř zdokumentovaných ohnisek, sporadických případů průjmu a případů pseudomembranózní kolitidy. Naproti tomu pouze jeden kmen toxinotypu XVI byl spojen s klinickým onemocněním a další dva toxinotypy X a XVII byly izolovány od asymptomatických pacientů. Ohniska A-B+ Clostridium difficile Doposud došlo ke čtyřem ohniskům spojeným s A-B+ Clostridium difficile. První ohnisko, hlášené v roce 1998 Alphou a kol., se vyskytlo v kanadské nemocnici během tříměsíčního období. Bylo hlášeno 16 případů nozokomiálního průjmu způsobeného C. obtížné na čtyřech nemocničních odděleních; osm z nich strávilo čas na jednom nemocničním oddělení. Toto ohnisko bylo spojeno s 19% mírou recidivy CDAD a dvěma úmrtími. Po vypuknutí nákazy byla změněna politika nemocnice v oblasti kontroly infekcí a byly zahájeny laboratorní testy na C. difficile byl změněn z ELISA testu toxinu A, který tyto kmeny A-B+ nedokázal detekovat, na test cytotoxicity v buněčné kultuře. Druhé ohnisko A-B+ se vyskytlo v Nizozemsku v letech 1997 až 1998. V tomto ohnisku bylo identifikováno 24 pacientů s A−B+C. tvrdý. Míra recidivy v tomto ohnisku byla 13 %, se sedmi epizodami těžkého průjmu a jedním úmrtím. Klonalita 16 dostupných izolátů z ohniska byla stanovena ribotypizací 16–23S rRNA. Propuknutí nákazy ustoupilo po změně chirurgické profylaktické antibiotické politiky, která vedla k ukončení podávání klindamycinu a zavedení strategických opatření pro kontrolu infekce. V roce 2001 bylo v japonské onkologické nemocnici identifikováno 10 pacientů s identickými kmeny A-B+C. tvrdý. Naše skupina nedávno popsala ohnisko viru A-B+C. difficile v dublinské nemocnici, která postihla 73 pacientů (Drudy a kol., v tisku). Molekulární typizace 90 izolátů ukázala, že 95 % izolátů bylo A−B+ (PCR ribotyp 017, toxinotyp VIII). Spektrum onemocnění a infekčnost A-B+ Clostridium difficile A-B+ Clostridium difficile způsobuje stejné spektrum onemocnění jako kmeny A+B+, od asymptomatické kolonizace až po závažnější fulminantní kolitidu. Míra recidivy C. difficile pozorovaná v naší studii (36 %) a dalších ohnisek způsobených kmeny s toxinovými variantami je podobná míře recidivy, kterou jsme hlásili my i další u kmenů s toxiny A+B+. Nicméně ohniska nákazy popsaná námi i dalšími lidmi dokumentují zvýšenou závažnost onemocnění spojenou s těmito izoláty A-B+. Mechanism (mechanismy) zodpovědné za toto pozorované zvýšení závažnosti onemocnění nejsou známy. Dříve jsme prokázali, že imunitní odpověď na toxin A je důležitá při určování klinického obrazu a průběhu CDAD. Nedávné studie in vitro ukázaly, že stejně jako TcdA je i TcdB silný enterotoxin, schopný způsobit 10krát větší toxicitu v explantátech lidského tlustého střeva než toxin A. Warney a kolegové prokázali, že nově vznikající epidemické klony A+B+ produkovaly 23krát více TcdB a 16krát více TcdA ve srovnání s kmeny toxinotypu 0. Ačkoli kinetika produkce toxinu B u izolátů A−B+ dosud nebyla změřena, tyto kmeny neprodukují toxin A, a proto je patologie pozorovaná v případech těžké kolitidy pravděpodobně výsledkem zánětlivých událostí hostitele modulovaných TcdB. Tato zjištění doplňují rostoucí počet výzkumů, které zdůrazňují význam toxinu B v patogenezi CDAD. Mechanismy nozokomiální nákazy, perzistence a přenosu Clostridium difficile jsou složité a nejsou u všech typů kmenů plně pochopeny. Jiní výzkumníci zjistili, že zvýšená sporulace a klíčení spor, spolu se zvýšenou antimikrobiální rezistencí, může přispívat k perzistenci klonálních izolátů A+B+ v nozokomiálních podmínkách. Mechanismy, kterými kmeny A-B+ přežívají, nebyly dosud rozsáhle studovány. Zvýšená rezistence vůči makrolidům, linkosamidům a streptograminu (MLS) a fluorochinolonům pozorovaná u našich izolátů z ohniska však pravděpodobně přispívá k perzistenci jak v nemocničním prostředí, tak v lidském střevě. Současné sledování v naší nemocnici naznačuje přetrvávající výskyt tohoto kmene, ačkoli míra incidence zůstává nízká. Popropuknutí nákazy v Nizozemsku ukázalo, že jejich izoláty A-B+ nepřetrvávaly. Tyto kmeny A-B+ již nejsou u pacientů v tomto zařízení detekovány (E. Kuiper, osobní komunikace). Rezistence na antibiotika u A-B+ Clostridium difficile Dřívější studie Delmeho a Avesaniho ukázala, že kmeny séroskupiny F (A-B+) byly obecně citlivé na klindamycin a erythromycin. Od té doby byl zdokumentován vznik antibiotické rezistence u MLS. Šestnáct izolátů A-B+ z ohniska nákazy v Nizozemsku bylo testováno na rezistenci vůči antibiotikům a všechny byly rezistentní vůči klindamycinu, erythromycinu a tetracyklinu a obsahovaly gen ermB, který kódoval rezistenci vůči MLS. Izoláty z ohnisek nákazy v Kanadě a Japonsku nebyly testovány na citlivost na antibiotika. Izoláty A-B+ z naší nemocnice byly také rezistentní vůči antibiotikům MLS a obsahovaly gen ermB. Naše kmeny A-B+ byly navíc rezistentní vůči několika novým třídám fluorochinolonů, včetně ciprofloxacinu, ofloxacinu, levofloxacinu, moxifloxacinu a gatifloxacinu. Pokud je nám známo, jedná se o první popis rezistence na fluorochinolony u tohoto typu kmene A-B+. Pituh a další. popsal vznik klonu A−B+ C. difficile rezistentní na klindamycin v polských nemocnicích. Protože C. difficile se v mnoha nemocničních laboratořích běžně nekultivuje, skutečný výskyt antimikrobiální rezistence u C. obtížné neznámé. Probíhající prospektivní studie provedená Evropskou společností C. difficile, studuje antimikrobiální rezistenci C. difficile a poskytne data o rezistenci na antibiotika u A-B+ a dalších typů C. tvrdý. Prevalence A-B+ Clostridium difficile Tyto variantní kmeny toxinů byly izolovány v několika zemích s různou mírou prevalence. Například v multicentrické studii ve Spojených státech byla hlášena míra výskytu 0,2 %, kde 2 ze 102 izolátů Clostridium difficile ze šesti klinických pracovišť byly A-B+. Ve Spojeném království byla popsána prevalence 3 % u 43 izolátů z 9 z 35 nemocnic, které předložily kmeny k typizaci do anaerobní referenční laboratoře v Cardiffu. Ve Francii byly v 3 různých pařížských nemocnicích zaznamenány míry 25 %. Naproti tomu jedna japonská studie popsala prevalenci A−B+ až 39 %. Nedávná studie v Izraeli navíc dokumentovala míry A-B+C. difficile s mírou 56 %. Nedávná studie v Argentině ukázala, že kmeny A−B+ během čtyřletého období zcela nahradily kmeny A+B+, přičemž podíl izolátů A−B+ se zvýšil z 12,5 % v roce 2000 na 97,9 % v roce 2003. Laboratorní diagnostika A-B+ Clostridium difficile Většina laboratorních diagnostických testů na Clostridium difficile je založena buď na kultivaci stolice, nebo na přímé detekci toxinu ve vzorcích stolice. Test cytotoxicity v buněčných kulturách je považován za zlatý standard pro detekci toxinů a dokáže detekovat pikogramové množství toxinu během 48 hodin. Buněčná kultura navíc dokáže identifikovat tyto kmeny A−B+ díky odlišné CPE způsobené těmito kmeny v důsledku jejich odlišné specificity pro substrát glukosyltransferázy. Enzymově vázané imunosorbentní testy (ELISA), které dokáží detekovat buď TcdA, nebo TcdB, jsou nejčastěji používaným diagnostickým přístupem díky snadnému použití a rychlé době odezvy, ačkoli tyto metody jsou méně citlivé než testy cytotoxicity. Specifické testy ELISA pro toxin A používají protilátky zaměřené na oblast CROP genu tcdA, která je u kmenů typu A-B+ deletována, a proto v těchto testech nereagují. Nedávná studie studijní skupiny Evropské společnosti pro klinickou mikrobiologii a infekční nemoci (ESCMID) o C. difficile ukázala, že mezi evropskými laboratořemi provádějícími C. difficile 58 % respondentů použilo testy ELISA, které dokáží detekovat pouze toxin A, a proto by kmeny toxinu A−B+ v tomto klinickém prostředí nebyly detekovány. Nepoužívání standardizovaných diagnostických metod C. difficile, které zahrnují toxin A i B, mohou vést k významnému podhodnocení výskytu C. tvrdý. Kultura C. difficile postrádá specificitu kvůli přítomnosti netoxigenních izolátů a trvá 48 hodin. Kultivace je však jediný způsob, jak typovat kmeny a testovat citlivost na antimikrobiální látky, a proto jediný způsob, jak identifikovat a monitorovat vznik a šíření virulentnějších nebo rezistentnějších kmenů. Molekulární analýza variant A−B+ Clostridium difficile Na varianty A−B+ bylo použito několik různých metod molekulární typizace, včetně testu restrikční endonukleázou (REA), ribotypizace 16–23S rRNA, polymorfismu délky amplifikovaného fragmentu (AFLP), multilokusové sekvenční typizace (MLST) a toxinotypizace (PCR-RFLP). Nedávná studie Lemeeho a kol. aplikoval MLST na 72 izolátů C. difficile z různých hostitelů, geografických lokalit, PCR ribotypů a toxigenních typů. Studované izoláty zahrnovaly osm izolátů A-B+ z USA, Japonska a Francie, kultivovaných z dospělých lidí a dětí. Všech osm izolátů patřilo ke stejnému sekvenčnímu typu a shluklo se do vysoce homogenní fylogenetické linie MLST, a to i přes svůj původ od nepříbuzných pacientů. Nulová alela pro jeden ze sedmi zkoumaných genů pro údržbu dále potvrdila nízkou genetickou diverzitu těchto typů A−B+. Van den Berg a kol. použili AFLP a ribotypizaci 16–23S rRNA k analýze 39 kmenů A−B+ ze sedmi různých zemí. AFLP rozpoznávala dva genotypy z 39 izolátů, zatímco dvě různé metody ribotypizace dokázaly rozlišit dva, respektive tři PCR ribotypy. Všechny tři metody prokázaly podobnou diskriminační schopnost při typizaci typů kmenů A−B+. Jedna mezinárodní studie porovnávala příbuznost 23 kmenů A-B+ pomocí tří typizačních metod: séroskupinování, ribotypizace 16–23S rRNA PCR a REA. Tato studie dokumentovala vysoký stupeň podobnosti mezi kmeny A-B+ z USA a Evropy. Dvacet jedna z 23 izolátů mělo deleci 1,8 kb na 3′ konci tcdA, což odpovídá toxinotypu VIII, a 20 z 21 testovaných mělo ribotyp PCR 017. REA byla nejdiskriminačnější typizační metodou, která rozlišila 11 typů REA mezi 23 izoláty. Tato metoda by mohla dále subtypovat 20 kmenů PCR 017/séroskupiny F do šesti různých typů REA. PCR ribotypizace a séroskupinování identifikovaly čtyři, respektive tři odlišné typy. Zbývající dva kmeny A-B+ testované v této mezinárodní studii byly kmen 8864, který byl jedinečný s použitím všech tří typizačních metod. Kromě toho měl kmen PCR ribotypu 110/séroskupiny X/REA DA1 stejný toxinový genotyp jako VPI 10463, ale in vitro neprodukoval toxin A. Závěrečné poznámky Zdá se, že výskyt kmenů Clostridium difficile A-B+ celosvětově roste. Tyto typy kmenů v současnosti představují významný počet C. tvrdý. Tyto izoláty mohou být nedostatečně hlášeny kvůli širokému používání diagnostických nástrojů, které detekují pouze TcdA. Přestože jsou zapotřebí další studie, které by určily, zda se patogeneze varianty toxinu CDAD (A−B+) liší od patogeneze kmenů toxinu A+B+, měli by si být lékaři vědomi rizika závažného onemocnění spojeného s těmito variantními typy kmenů. TcdB pravděpodobně hraje významnější roli v patogenezi C. obtížnější, než se dříve myslelo, a budoucí práce by se měla zaměřit na expresi a regulaci tohoto toxinu, stejně jako na modulaci imunitní odpovědi hostitele. Nedostatek vhodných genetických nástrojů pro manipulaci s C. difficile a nedostatek izogenních mutantů může bránit pokroku.